У процесі проведення генетичних досліджень ми часто стикаємося з недостатньою кількістю зразків РНК, наприклад, для вивчення крихітних анатомічних пухлин порожнини рота, навіть одноклітинних зразків і зразків специфічних генних мутацій, які транскрибуються на дуже низькому рівні в клітинах людини.Звичайно, для тесту на COVID-19, якщо мазки не будуть у тому місці або недостатньо разів під час відбору зразків, розмір зразка буде дуже низьким, тому Комісія з охорони здоров’я та планування сім’ї виступила два дні тому і пройшли тест, і якщо пробовідбірник нуклеїнових кислот не взяв шість проб, ви можете повідомити про це.
Чутливість реагенту важлива, оскільки ми маємо ту чи іншу проблему, тож що ми можемо зробити, щоб підвищити чутливість RT-PCR?
Перш ніж ми обговоримо можливі рішення, давайте згадаємо про дві великі складності ситуації, про яку ми щойно згадали.
Перш за все, ми турбуємося про втрату РНК, коли у нашому зразку є лише кілька популяцій клітин.Якщо використовуються традиційні методи розділення та очищення, такі як метод колонки або метод преципітації нуклеїнової кислоти, існує велика ймовірність того, що кілька зразків будуть втрачені.Одне з рішень полягає в тому, щоб додати молекулу-носій, таку як тРНК, але навіть у цьому випадку немає гарантії, що наш експеримент із відновлення вдасться.
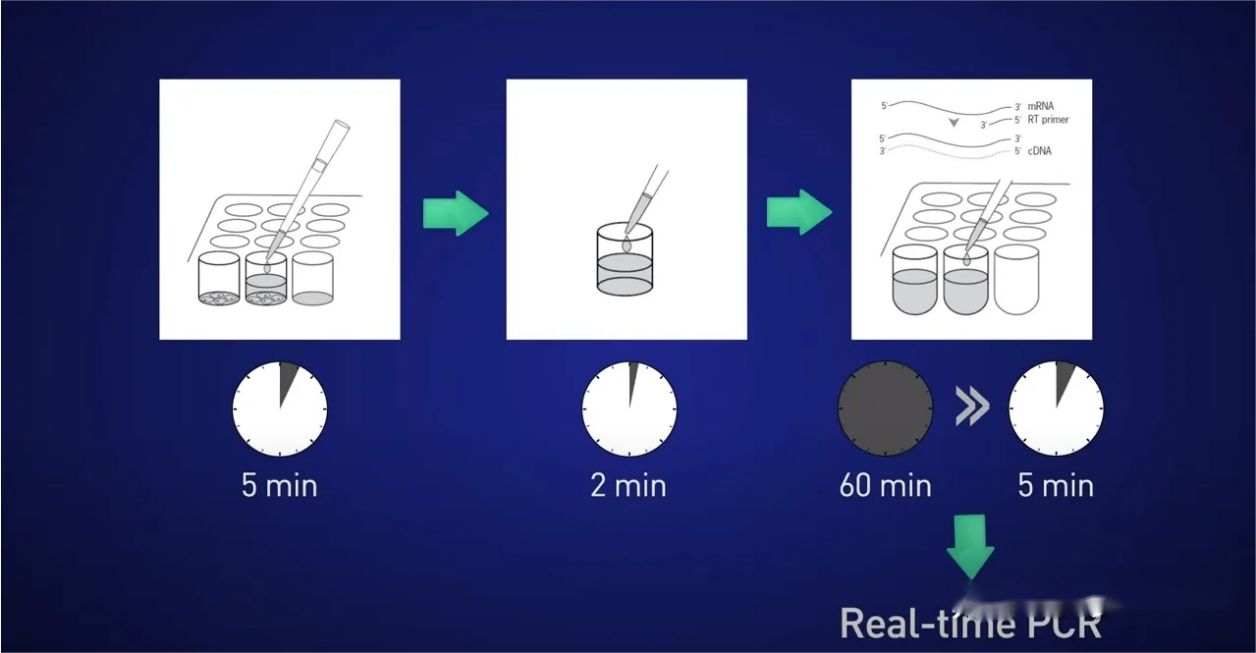
Так який спосіб кращий?Хорошим варіантом для культивованих клітин або мікроанатомічних зразків є використання прямого лізису.
Ідея полягає в тому, щоб розділити клітини протягом 5 хвилин, вивільнити РНК у розчин, потім зупинити реакцію на 2 хвилини, потім додати лізат безпосередньо до реакції зворотної транскрипції, щоб не втратити РНК, і, нарешті, безпосередньо ввести отриману кДНК у реакцію в реальному часі.
Але що, якщо через обмежену вихідну точку або невелику кількість експресії цільового гена ми зможемо переробити всю РНК і все одно не надамо достатньо шаблонів для отримання хорошого сигналу в реальному часі?
У цьому випадку етап попереднього посилення може бути дуже корисним.
Нижче представлена схема підвищення чутливості після зворотної транскрипції.Перш ніж почати, нам потрібно запитати, які мішені нас цікавлять, щоб розробити конкретні праймери для цих мішеней для попередньої ампліфікації.
Цього можна досягти шляхом створення змішаного праймера до 100 пар праймерів і циклу реакції від 10 до 14 разів.Тому для попередньої ампліфікації отриманої кДНК необхідна Master Mix, спеціально розроблена для цієї вимоги.
Причина встановлення кількості циклів між 10 і 14 полягає в тому, що ця обмежена кількість циклів забезпечує випадковість між різними цілями, що є вирішальним для дослідників, яким потрібна кількісна молекулярна інформація.
Після попередньої ампліфікації ми можемо отримати велику кількість кДНК, так що чутливість виявлення на задній частині значно покращується, і ми навіть можемо розбавити зразок і виконати кілька реакцій ПЛР у реальному часі, щоб усунути можливі випадкові помилки.
Час публікації: 11 квітня 2023 р